當地時間周五(1月6日),美國食品藥品監督管理局(FDA)宣佈,該機構以“加速批準途徑”通過阿爾茨海默病藥物“侖卡奈單抗”(Lecanemab)。
(來源:FDA官網)
侖卡奈單抗由渤健(Biogen)與衛材株式會社共同開發,是阿爾茨海默病(AD)所致輕度認知障礙和輕度AD的抗淀粉樣蛋白原纖維抗體,患者每兩周靜脈註射一次,會對疾病病理學產生影響,減緩疾病的進展。
侖卡奈單抗將以“Leqembi”的名稱在美國市場上市。價格方面,渤健和衛材表示,這款新藥的定價為每年26,500美元,約合18.1萬元人民幣。
阿爾茨海默病是一種起病隱匿的進行性發展的神經系統退行性疾病。臨床上以記憶障礙、失語、失用、失認、視空間技能損害、執行功能障礙以及人格和行為改變等全面性癡呆表現為特征,病因迄今未明。65歲以前發病者,稱早老性癡呆;65歲以後發病者稱老年性癡呆。
FDA在聲明中稱,這種不可逆的腦部疾病影響著超過650萬美國人,侖卡奈單抗的獲批是與該疾病鬥爭道路上的重要進展。根據此前的對照試驗,采用侖卡奈單抗療程的患者記憶力和思維敏捷度的下降速度減慢27%。
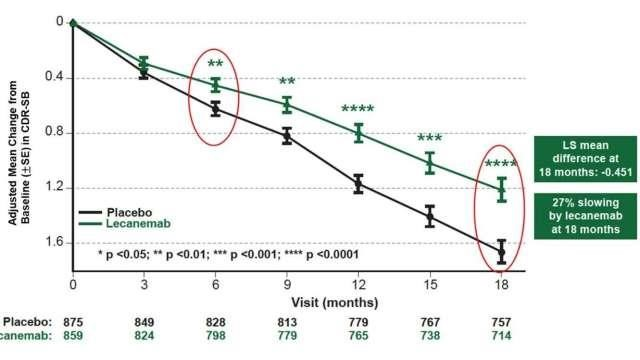
聖路易斯華盛頓大學醫學院神經學教授Joy Snider指出,侖卡奈單抗不是治愈方法,並不會讓患者痊愈,也不能完全阻止疾病發展。但Snider表示,減緩疾病的進展可能對患者及其傢人有意義,因此這仍算得上是一個好消息。
不過,在患者獲得侖卡奈單抗療程前,可能需要等待幾個月的時間。因為患者們需要接受測試,以證明他們處於該疾病的早期階段。南加州大學衛生政策專傢Jakub Hlavka稱,患者很可能將排起長隊。
另需指出的是,侖卡奈單抗的療程存在較高的風險。據解,實驗組患者中有12.5%出現腦水腫或腦積液的副作用,17%出現以微出血為主的腦出血,分別高於對照組的2%和9%。
相關研究人員也警告,該藥物仍需進一步試驗來確定其療效和安全性。
目前侖卡奈單抗是通過“加速批準途徑”獲得批準的,是一種有條件的藥物上市許可。如果FDA確認該藥物的有效性和安全性,可能會在今年晚些時候考慮全面批準,但在這之前,藥物不太可能進入美國醫保覆蓋名單。
2021年,渤健的另一款阿爾茨海默病藥物“阿杜那單抗”(Aduhelm)通過美國FDA的“加速批準”。但之後三名懷疑審查過程的外部顧問辭職,FDA也因此一直受到各界人士和公眾的抨擊。
去年年底,美國國會公佈的一份報告顯示,FDA在批準阿杜那單抗的過程中“充斥著違規行為”,並且該藥物是否有效存在很大的不確定性。