中國創新藥“出海”再下一城。美國當地時間11月13日,傳奇生物(LEGN.US)宣佈,其全資子公司傳奇生物愛爾蘭有限公司與瑞士制藥巨頭諾華制藥(NVS.US)就特定靶向DLL3的嵌合抗原受體T細胞(CAR-T)療法簽訂獨傢全球許可協議,授予諾華開發、制造和商業化包括自體CAR-T療法LB2102(NCT05680922)在內的細胞療法的全球獨傢權利,諾華抗原將其T-Charge平臺用於其生產。
根據協議,傳奇生物將獲得1億美元的預付款,並有資格獲得高達10.1億美元的臨床、監管和商業裡程碑付款以及分級特許權使用費,合計交易金額達到11.1億美元。
根據許可協議,傳奇生物將在美國進行LB2102的I期臨床試驗,諾華將進行許可產品的所有其他開發。
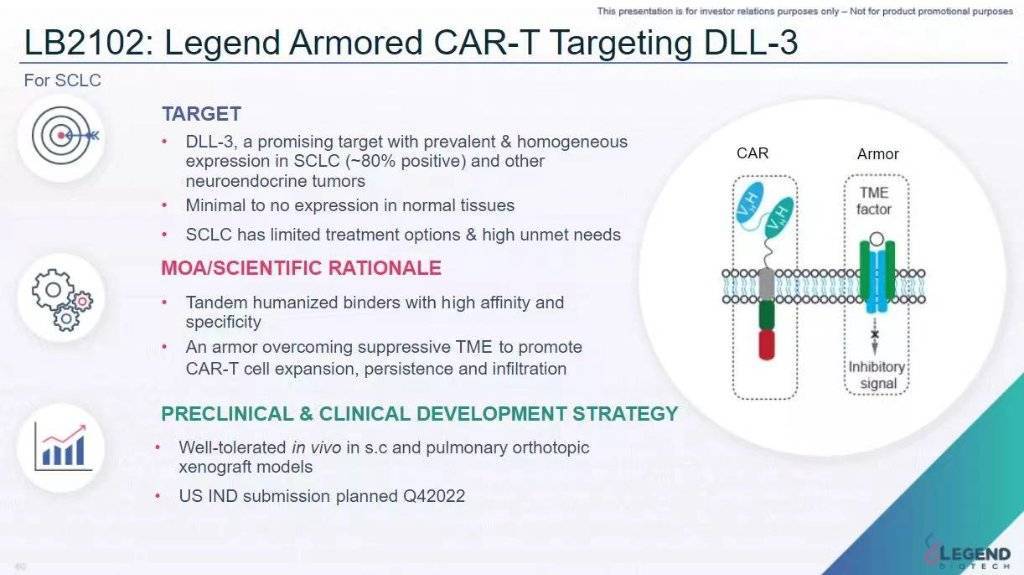
LB2102新藥臨床試驗(IND)申請已於2022年獲得美國食品藥品監督管理局(FDA)批準,用於治療廣泛期小細胞肺癌和大細胞神經內分泌癌。2023年,美國FDA授予該產品“孤兒藥”稱號。
CAR-T是一種新型的精準靶向療法,指的是從患者身上提取出T細胞後,在體外利用基因工程技術,將一個含有識別腫瘤且激活T細胞的嵌合抗原受體的病毒通過載體轉入T細胞,將之改造成CAR-T細胞,經過擴增後再重新輸回患者體內,高效快速地識別並精準殺傷病變細胞,從而達到治療疾病的目的,讓患者恢復健康。
從2008年Fred Hutchison腫瘤研究所首次采用CAR-T細胞治療B細胞淋巴瘤,證明這種方法的安全性至今,在短短十餘年的時間裡,這種高度個性化、精準化的療法迅速成為腫瘤治療界的一種明星療法。
2017年,諾華的Kymriah成為第一款獲批上市的CAR-T細胞療法。自此以後,CAR-T細胞療法的商業化按下“加速鍵”。截至目前,全球獲批的CAR-T細胞療法已經多達10款,2022年2月底,傳奇生物與強生(JNJ.US)合作的首款產品Carvykti(西達基奧侖賽,cilta-cel)獲得美國FDA批準上市,成為中國創新藥“出海”的裡程碑事件。
弗若斯特沙利文預測,按照銷售價值計算,全球CAR-T市場規模已經從2017年的0.1億美元迅速增長至2020年的11億美元,預計全球CAR-T細胞療法市場銷售價值會在2030年達到218億美元。
但隨著競爭加劇,CAR-T的行業格局也在悄然發生變化。
上市最早的Kymriah,其銷售趨勢已經出現下滑。財報數據顯示,2022年,Kymriah實現營收5.36億美元,同比下降9%;2023年前三季度,Kymriah的銷售收入達到3.88億美元,與2022年同期的3.97億美元相比也有輕微下滑。
目前,全球銷售額最高的CAR-T細胞療法是來自吉利德(GILD.US)的Yescarta,今年前三季度的銷售額達到11.3億美元。
作為CAR-T賽道的後起之秀,Carvykti的銷售也在迅速放量。根據合作夥伴強生披露的數據,Carvykti今年前三季度的累計銷售達到3.41億美元。
為在下一階段的行業排位賽中再次奪得先機,諾華正在加緊深化CAR-T的研發佈局。而此次引入靶向DLL3的CAR-T細胞療法並非是傳奇生物第一次與諾華合作。
2023年4月,傳奇生物宣佈,其與強生和諾華就CAR-T產品技術轉讓、生產及臨床供應服務簽訂協議,繼續加碼CAR-T生產。根據協議,傳奇生物與強生將和諾華啟動必要的技術轉讓活動,以便諾華執行Carvykti的生產工藝。
上述的T-charge平臺更是諾華在CAR-T領域下一階段佈局的基石。
2021年第63屆美國血液學會(ASH)上,T-charge平臺首次亮相,諾華同時公佈基於該平臺開發的兩款CAR-T細胞療法的1期臨床試驗早期結果,分別是YTB323(抗CD19)和PHE885(抗BCMA)。
傳奇生物方面對時代財經表示,諾華T-Charge平臺是下一代CAR-T細胞療法生產平臺,旨在保持T細胞的幹性,並促進CAR-T細胞主要在體內擴增。T-Charge平臺旨在減少在體外長時間培養的需求,使T細胞具有更大的增殖潛力,並減少耗竭的T細胞。
傳統的CAR-T細胞制備周期需要2-4周,但T-Charge平臺隻需不到2天就可以完成CAR-T細胞的生產,輸註至患者體內後可進行大幅增殖;此外,通過T-Charge平臺開發的CAR-T細胞產品所需的輸註劑量僅為現有CAR-T細胞產品的1/10~1/50。
和諾華的合作達成後,LB2102將是諾華首次將T-Charge平臺應用於靶向實體瘤的細胞療法候選藥物。
目前CAR-T細胞療法獲批的適應癥主要為血液腫瘤,一名從事免疫細胞療法研發的人士曾對時代財經指出,實體瘤的致密性強、微環境復雜,且實體瘤類型繁多,靶點表達異質性高,這都給CAR-T在實體瘤方面的應用帶來挑戰。
DLL3是Notch通路配體傢族的成員,在Notch信號傳導中發揮關鍵作用,在小細胞肺癌中有高表達。藥融雲數據顯示,目前全球靶向DLL3的在研藥物有17款,包括單/雙抗、ADC和CAR-T等。
小細胞肺癌約占肺癌的15%-20%,其特點是腫瘤生長迅速,且確診時大約隻有1/3的患者處於局限期,2/3的患者處於廣泛期。局限期小細胞肺癌患者的中位生存期大約為16~22個月,而廣泛期小細胞肺癌治療後僅為10個月。
傳奇生物首席科學官兼業務拓展負責人方國偉博士表示:“我們相信LB2102具有創新的CAR設計和裝甲機制,可以增加其抗腫瘤活性。臨床前證據表明,自體CAR-T可能是小細胞肺癌患者的差異化治療選擇。LB2102中獨特的候選設計與T-Charge平臺相結合,有可能為小細胞肺癌患者帶來變革性的獲益。”