制藥企業們“擠破頭”搶灘減肥賽道,至於誰能主宰這片戰場,要論先機,更取決於產品本身質素。在安全可控的前提下出色的減肥效果是終極必殺技,用藥的便捷性與依從性提供另一大突破口,產品代際升級將保證長遠的競爭力。
由GLP-1引爆的減肥風潮正席卷全球,巨大的需求打開千億美元級別的市場空間。面對如此誘人的前景,國內外企業爭相搶灘,減肥藥開發直接進入白熱化競爭。
領跑者諾和諾德與禮來叱吒風雲,市值屢創新高。前者手握司美格魯肽皮下制劑Wegovy、口服司美格魯肽和雙重機制療法CagriSema等雄厚資產,後者則有替爾泊肽、口服GLP-1R激動劑orforglipron和GIPR/GLP-1R/GCGR三重激動劑retatrutide等重磅籌碼傍身。層次迭代分明,天王山之戰持續上演中。
各路後起之秀也已集結在減肥這條超級賽道上。輝瑞暢想憑借雙子星danuglipron和lotiglipron搶食減肥市場千億美元份額,然而每日口服一次的lotiglipron已經隕落。安進旗下GIPR抗體融合GLP-1新藥AMG133早期數據一出,艷驚四座。勃林格殷格翰的GLP-1R/GCGR雙靶點激動劑survodutide亦有一定的想象空間。
國內藥企中,信達傾力挖掘從禮來引進的GLP-1R/GCGR雙激動劑IBI362的潛能,進度領先。恒瑞主打多元,每日一次的諾利糖肽推進至II期臨床,GLP-1R/GIPR激動劑HRS9531和口服GLP-1R激動劑HRS-7535初顯減重效果。華東醫藥憑借每日一次的利拉魯肽搶先卡位減重市場,後備單靶、雙靶、三靶和口服小分子的系列GLP-1管線。此外,還有石藥集團、豪森和中國生物制藥等重量級玩傢下註。
整個減肥賽道的角逐激烈程度不言自明。就目前來看,跑在前列的選手都有機會從中分一杯羹。畢竟,減肥藥受眾廣泛,市場容量足夠大,而既往獲得FDA批準用於長期減重的藥物僅有6款,需要更多新藥來填補巨大的需求缺口。再加上,減肥藥兼具醫療和消費屬性,且肥胖人群不斷擴增,未來市場增長空間明確。
至於誰能主宰這片戰場,要論先機,更取決於產品本身質素。在安全可控的前提下出色的減肥效果是終極必殺技,用藥的便捷性與依從性提供另一大突破口,產品代際升級將保證長遠的競爭力。
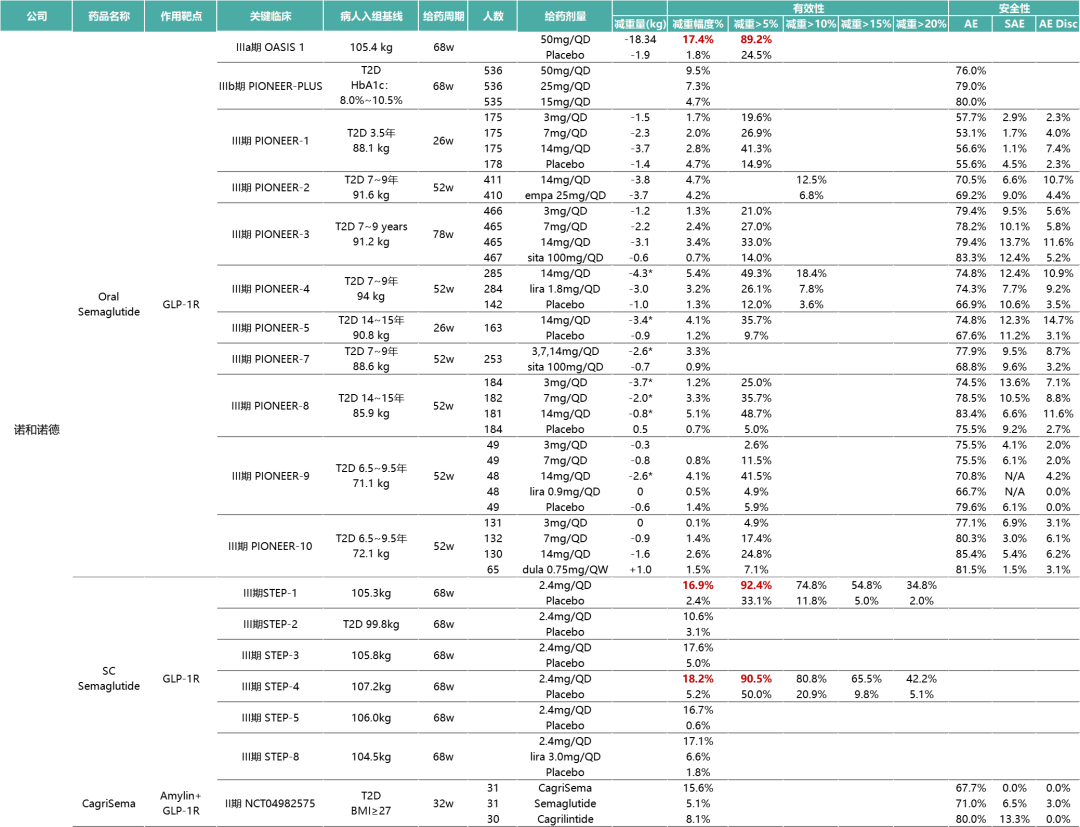
註:部分減肥藥物關鍵臨床研究數據對比(*數據為安慰劑調整後數據)
諾和諾德 vs. 禮來:王不見王
減肥賽道上,諾和諾德和禮來總是在行業的觀察與討論中,持續拉高著市場的期待值。高手過招間,頗有一種“王不見王”的既視感。
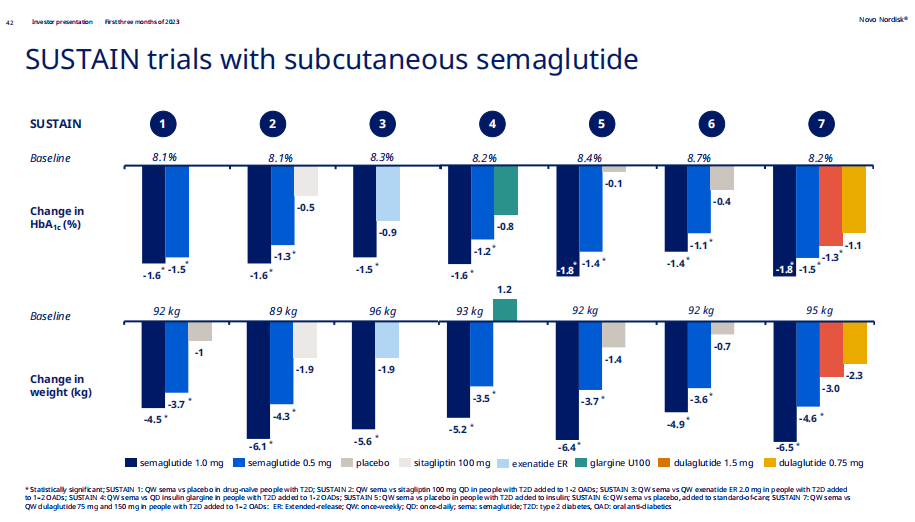
諾和諾德的打法思路已十分清晰,即圍繞提高GLP-1受體激動劑司美格魯肽的療效“天花板”展開,包括研發口服片劑、摸索最優劑量、創新組合療法等。而司美格魯肽註射劑到片劑的升級便是諾和諾德提高競爭壁壘的第一步。
面對口服多肽的難題,諾和諾德選擇利用吸收增強劑SNAC(N-(8-[2-羥基苯甲酰基]-氨基)辛酸鈉)來修飾司美格魯肽。與註射劑型相比,司美格魯肽口服片劑無疑為患者供更方便的選擇。
在代號名為PIONEER(先驅者)的研究中,諾和諾德評價司美格魯肽片劑3/7/14mg三個劑量在不同基線患者中的療效與安全性。對比PIONEER研究與SUSTAIN研究(評估司美格魯肽1.0mg註射劑型系列研究)的療效數據來看,以基線HbA1c 8.1%、體重92kg亞組舉例,片劑14mg的減重數據(-4.2kg)並沒有打敗註射劑1.0mg的減重數據(-4.5kg)。
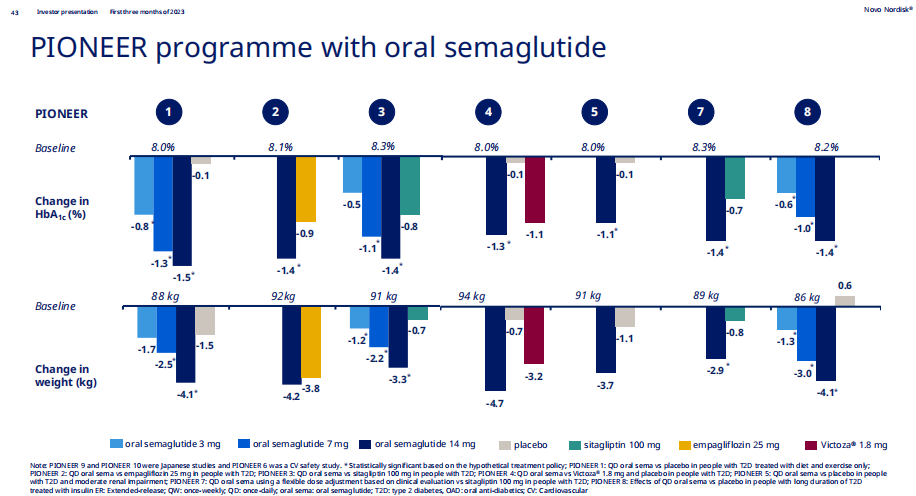
對減肥人士來說,療效會是制勝王道,每日一次的片劑在療效更優的每周一次的註射劑面前也會缺少說服力。於是諾和諾德緊接著又開展PIONEER-PLUS和OASIS系列研究,直接將司美格魯肽片劑的最高劑量拉到50mg。
最新公佈的IIIa期OASIS-1研究結果顯示,基線平均體重為105.4kg的患者在治療68周後,司美格魯肽片50mg組患者平均體重減輕17.4%(-18.34kg),而安慰劑組減輕1.8%(-1.9kg);在治療68周後,司美格魯肽片50mg組中有89.2%的患者體重減輕幅度≥5%,而安慰劑組這一比例僅為 24.5%。對比評價司美格魯肽2.4mg註射劑減重效果的STEP-1研究數據來看,基線平均體重為105.3kg的患者在68周後體重減輕16.9%。這意味著司美格魯肽片50mg的減重效果已經可以媲美司美格魯肽2.4mg註射劑。
減重效果之外,安全性和耐受性是司美格魯肽片需要被額外關註的點。OASIS-1研究中最常見的不良事件是胃腸道反應,且絕大多數為輕度到中度。不過,諾和諾德並未披露具體的安全性數據。目前看來,司美格魯肽片50mg的安全性還有待更大樣本量的III期數據給出答案。但毫無疑問的是,司美格魯肽片劑的治療效果已經觸到註射版本的高度。
復方制劑CagriSema註射液則是諾和諾德提高競爭壁壘的第二步。CagriSema註射液是一款一周一次皮下註射給藥的長效療法,主要組分是司美格魯肽和長效胰淀素(amylin)類似物Cagrilintide。Amylin又稱胰淀粉樣多肽(IAPP),可通過飽腹感通路的中樞控制減少食物攝入。CagriSema註射液結合Cagrilintide+Semeglutide的優點,為減肥提供綜合療法。
II期研究(NCT04982575)結果顯示,治療32周後,與Cagrilintide單藥組 (-8.1%) 和司美格魯肽單藥組(-5.1%)相比,CagriSema組的體重平均變化更為顯著(-15.6%)。比較有趣的是,雖然CagriSema作為一種組合療法,但其顯示出比Sema和Cagri單藥更優異的安全性與耐受性。與CagriSema相比,Sema和Cagri單藥的停藥和嚴重副作用更為普遍。
不僅如此,諾和諾德曾放出豪言,預期CagriSema在III期研究中可使非糖尿病肥胖患者的體重減輕至少25%。CagriSema到底能否發揮出療效“1+1>2”疊加安全性”1+1<2“的buff,也隻能待大樣本的III期臨床數據揭曉時,讓諾和諾德為我們給出答案。
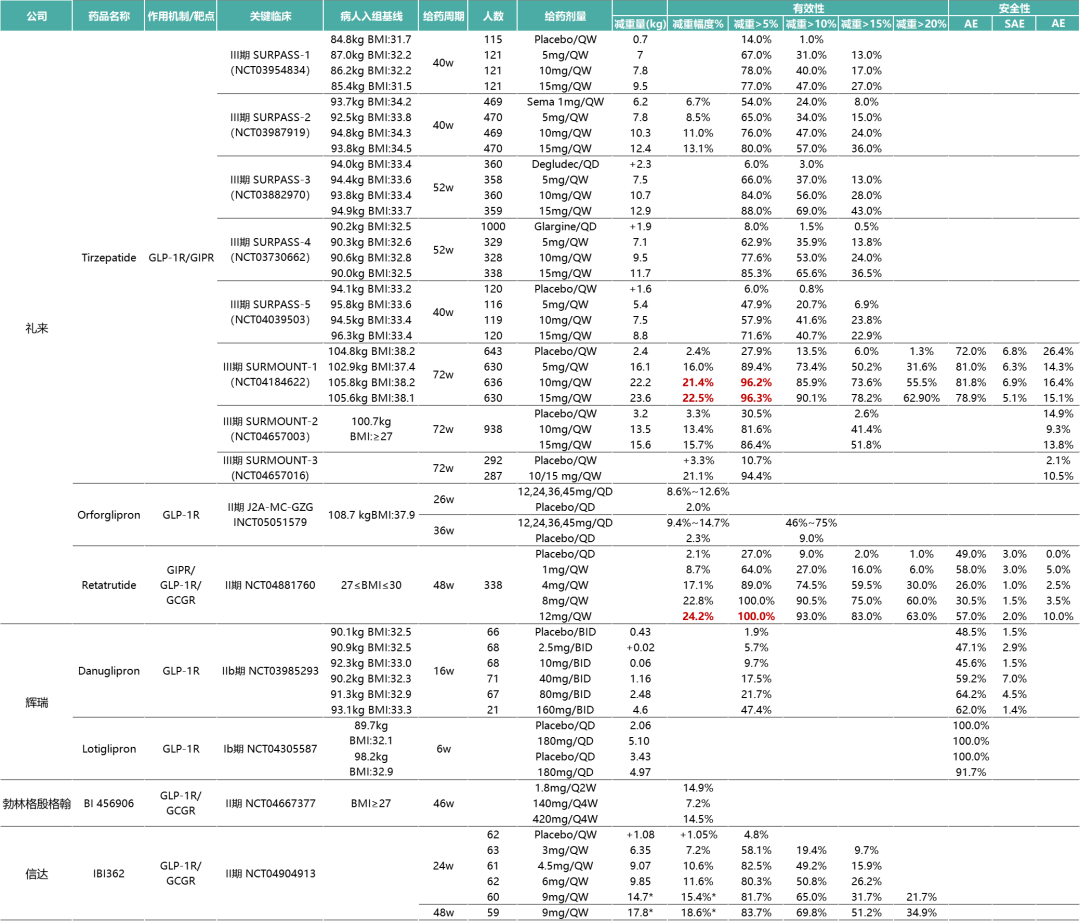
高手對決,講究佈局。諾和諾德日拱一卒,禮來則步步為營,小分子GLP-1R激動劑orforglipron、GIPR/GLP-1R雙重激動劑Tirzepatide(替爾泊肽)、GIPR/GLP-1R/GCGR三重激動劑retatrutide齊驅並進。
禮來推出orforglipron的意圖很清晰,即全力壓縮司美格魯肽片的市場想象空間。與司美格魯肽片服藥後半小時禁食的要求不同,orforglipron不受飲食限制。論依從性,這局禮來略勝一籌。
作為全球進展最快的小分子GLP-1R激動劑,orforglipron在肥胖或超重患者中顯示出明顯的減重獲益。II期研究(NCT05051579)顯示,在基線體重為108.7kg的肥胖或超重成年患者中,接受12、24、36、45mg orforglipron治療的患者在36周後體重減輕9.4%~14.7%,而安慰劑組為2.3%。僅從減重數據上看,45mg orforglipron的療效稍弱於司美格魯肽片50mg。
目前,禮來已加速啟動3項orforglipron針對肥胖和超重患者的ATTAIN系列研究(即ATTAIN-1、ATTAIN-2和ATTAIN-J研究),預計將於2025年完成。Orforglipron與司美格魯肽片在療效與安全性上的優劣,還需待樣本量更大的III期研究結果來確證。
在雙靶點賽道,Tirzepatide正大步流星,頻繁刷新著市場對減肥藥物的認知和預期。最新公佈的III期SURMOUNT-3研究數據顯示,經過前12周的生活方式幹預,再接受72周Tirzepatide治療後,基線平均體重為109.5kg患者減重平均幅度高達26.6%。換句話說,Tirzepatide將這類患者的體重減少1/4,顯著的效果已無形之中在GLP-1賽道的玩傢們面前築起一座難以逾越的高墻……
禮來也選擇直面諾和諾德,啟動頭對頭比較Tirzepatide與司美格魯肽減肥作用的III期SURMOUNT-5研究,預計2024年末完成。當然,禮來的佈局遠不止於此,Tirzepatide正在同步進行肥胖相關合並癥的多項III期研究,包括SURMOUNT-MMO研究(減少肥胖合並癥及死亡風險)、SURMOUNT-OSA研究(阻塞性睡眠呼吸暫停)、SURMOUNT-NASH研究(非酒精性脂肪性肝炎)、TREASURE-CKD研究(慢性腎病)、SUMMIT研究(射血分數保留的心衰)、SURPASS-CVOT研究(心血管風險)等。
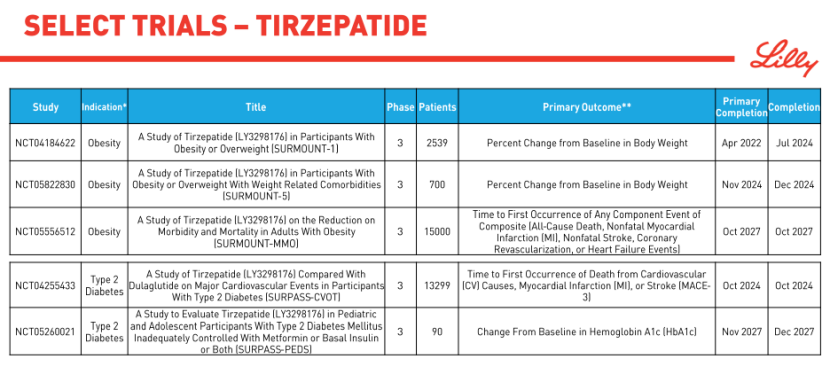
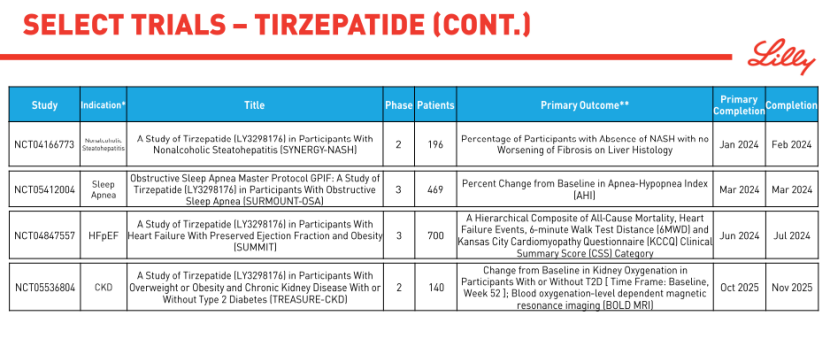
面對Tirzepatide展開的全方位攻勢,司美格魯肽憑借心血管結局獲益先下一城。8月初,諾和諾德公佈註射司美格魯肽心血管結局研究(CVOT)SELECT試驗的初步結果。這是一項為期5年的超大規模臨床研究,共納入17,604例患有心血管疾病且不伴糖尿病的超重或肥胖患者。數據顯示,與安慰劑相比,接受每周一次皮下註射司美格魯肽(2.4 mg)治療的患者主要心血管不良事件(MACE)發生風險降低20%。
肥胖是導致心血管疾病的重要因素之一。但迄今為止,還沒有一種經批準的減肥藥物被證明能控制體重的同時降低心臟病發作、中風或心血管死亡風險。不言而喻,SELECT研究有著極其重要的裡程碑意義,同時也為燃燒GLP-1千億市場的火堆又添一把新柴。繼司美格魯肽後,禮來針對Tirzepatide佈局的SURMOUNT-MMO和SURPASS-CVOT研究同樣是瞄準肥胖/糖尿病合並心血管風險這一巨大的患者群體。
升級迭代的GLP-1R/GIPR/GCGR三靶激動劑Retatrutide方面,II期臨床研究(NCT04881760)顯示,在治療48周時,接受每周註射12mgRetatrutide治療的肥胖或超重(糖尿病除外)成人患者平均體重減輕24.2%。不僅如此,禮來還表示患者在接受Retatrutide治療48周後,體重尚未達到平臺期。這也意味著隨著未來周期更長的研究進行,Retatrutide可能會顯示出更高幅度的體重減輕。
為此,禮來目前正在全力加速推進Retatrutide的III期TRIUMPH研究,其中包括4項關鍵註冊性試驗,旨在評估Retatrutide用於肥胖和超重患者的慢性體重管理、阻塞性睡眠呼吸暫停(OSA)和膝關節骨關節炎(OA)的安全性和有效性。
海外巨頭推進減肥市場兵線,戰火升級
諾和諾德與禮來兩大霸主在減肥領域沉淀的實力固然強悍,其他有潛力的巨頭玩傢也不在少數。在一項又一項亮眼的臨床數據釋放後,輝瑞、安進和勃林格殷格翰逐漸出線。
輝瑞佈局減肥的思路直白明——大舉押註口服小分子GLP-1R激動劑,相比口服肽類,此類藥物的優勢在於用藥前後沒有嚴格的禁食限制。每日2次(BID)的danuglipron與每日1次的lotiglipron雙管齊下,輝瑞意圖打造潛在“best-in-class”小分子。然而,由於轉氨酶升高的安全性信號出現,輝瑞果斷放棄半衰期更長的lotiglipron,聚焦danuglipron這一有生力量。
Danuglipron的減重效果在2項II期研究得到初步驗證。經過12周治療,200mg的高劑量使2型糖尿病患者的體重減少5.37kg;針對單純肥胖患者,減重更明顯達7.17kg。
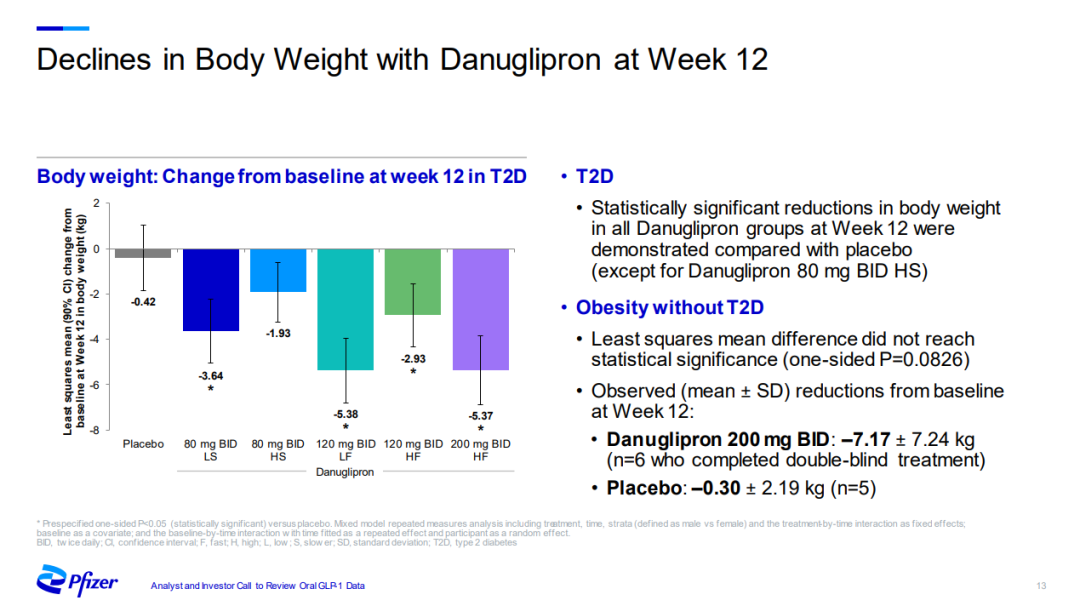
另一項為期16周的研究顯示,接受80mg和120mg藥物治療的患者體重均顯著下降,減重絕對值分別為2.48kg和4.60kg。
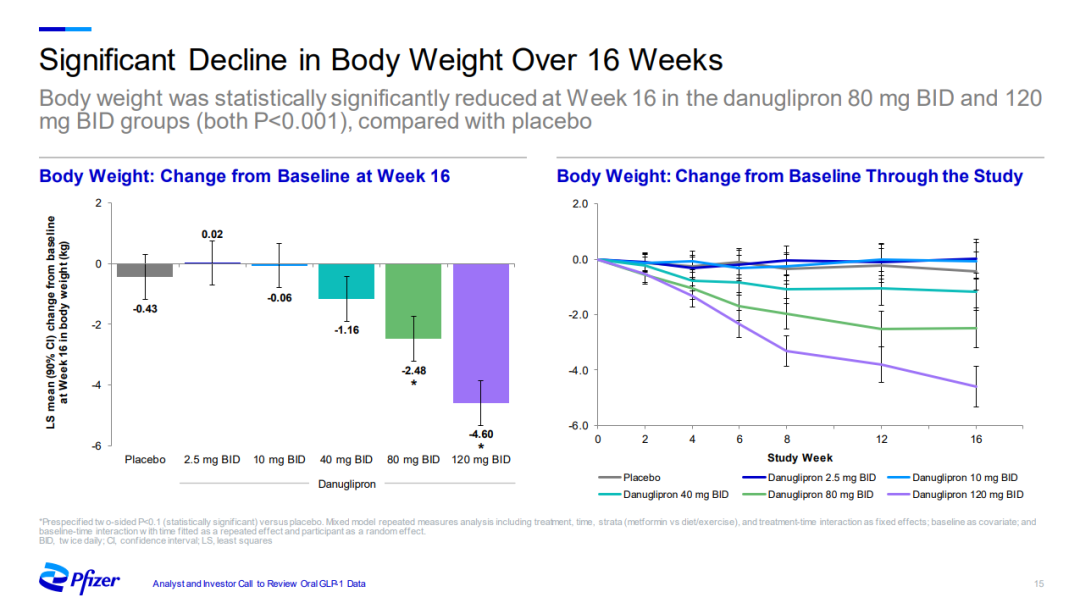
不良反應導致的治療中止問題需要關註。55%的肥胖患者因不良反應停止200mg的danuglipron治療。另一項研究中,120mg劑量組有34%的患者因不良反應中止治療,安慰劑組的這一比例為8%。
顯而易見,如若完全依靠danuglipron來搶占未來小分子GLP-1R激動劑市場制高點,可能算不上一個上乘之選。因此,輝瑞在推進danuglipron臨床開發的同時,還致力於鍛造更具競爭力的每日1次改良版本。
雙靶點組合也備受各大玩傢青睞。安進攜AMG133來勢洶洶,這款first-in-class雙特異性抗體多肽偶聯物同時抑制GIPR和激活GLP-1R。不難發現,安進在GIPR的作用方式選擇上是與行業主流反其道而行的,以禮來為代表的一眾藥企則傾向激動GIPR。安進研發部執行副總裁David M. Reese揭秘,臨床前和人類遺傳學數據提示GIPR抑制可作為一種減肥機制,結合GLP-1R激動或能發揮協同作用。

別出心裁的分子設計似乎擴大AMG133從減肥藥內卷中突圍的贏面,不但使皮下註射頻率降低至每4周1次,而且賦予其迅速、強勁且較為持久的減重效應。
經過12周治療,即3次給藥後,140mg低劑量組減重幅度為7.19%,420mg高劑量組平均減重14.52%。研究未觀察到減重平臺期,換言之,14.52%的降幅尚未觸碰到AMG133減重的天花板,如果延長治療期,患者體重可能進一步下降。此外,280mg組的減重效果在停藥的150天內與第12周基本持平,420mg組在觀察期結束時實現減重11.2%,提示停藥後反彈較小。
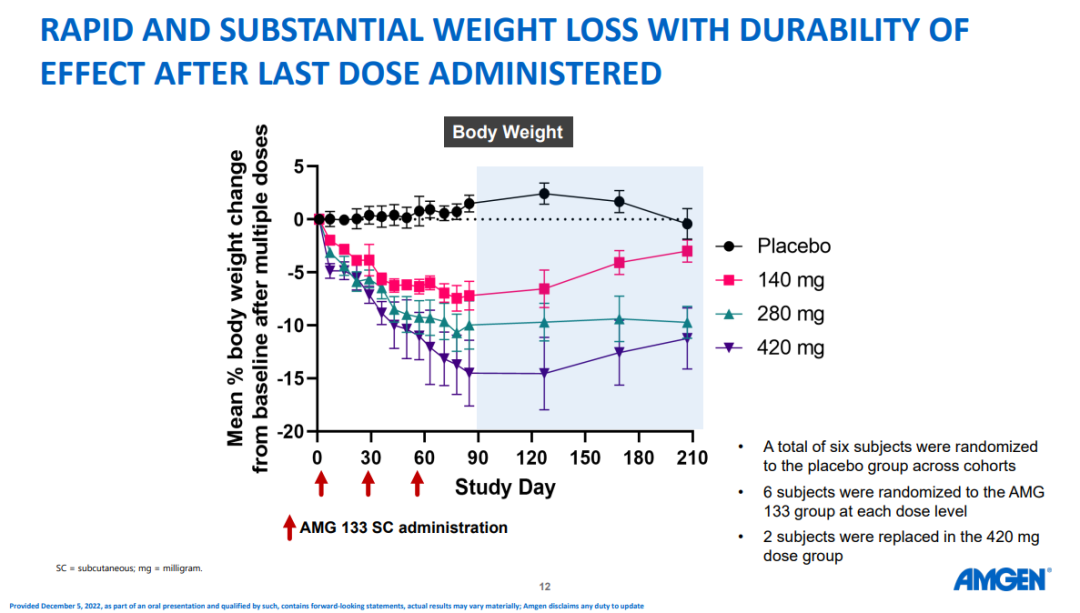
漂亮的I期數據為AMG133創下高起點開局,但AMG133還需要接受更大規模和更長時間的多項臨床考驗。
安進已經開啟一項面向570例超重或肥胖患者的II期研究(NCT05669599),主要終點為第52周時的體重變化,預計將於2024年10月完成主要研究。除AMG133,安進正在I期臨床試驗(NCT05406115)中探索小分子肥胖藥AMG786的療效。
勃林格殷格翰是GLP-1R與GCGR雙靶點激動策略的忠實擁躉者。早在2011年,它就牽手Zealand Pharma佈局新型GLP-1R/GCGR雙激動劑開發,曾先後退還日制劑ZP2929以及胰淀素類似物的全部權益,將合作重心聚焦於周制劑survodutide(BI 456906)。
Survodutide在I期研究(NCT03591718)初露鋒芒,治療16周後,肥胖患者體重降幅最高可達13.7%。
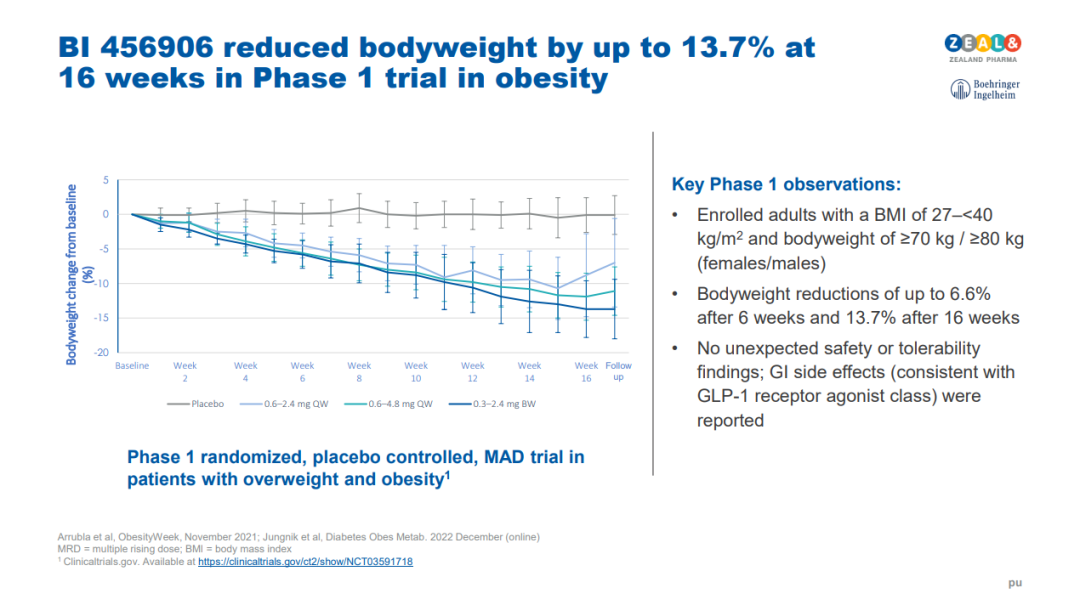
II期研究(NCT04667377)將療程延長至46周,通過20周劑量遞增和26周維持劑量治療,所有隨機分配至4.8mg劑量組的患者減重14.9%,而實際完成研究的4.8mg劑量組體重下降接近19%。同樣未觀察到減重平臺期。
安全性方面,4.2%的Survodutide治療組報告嚴重不良反應,與安慰劑組的6.5%差不多。不過,兩組患者中分別有24.6%和3.9%的患者因不良反應而終止治療,主要由於劑量遞增期發生的胃腸道不良事件。勃林格殷格翰對此表示,如劑量遞增速度更為和緩,不良事件發生次數可能會下降。
國內新秀就位,火力全開
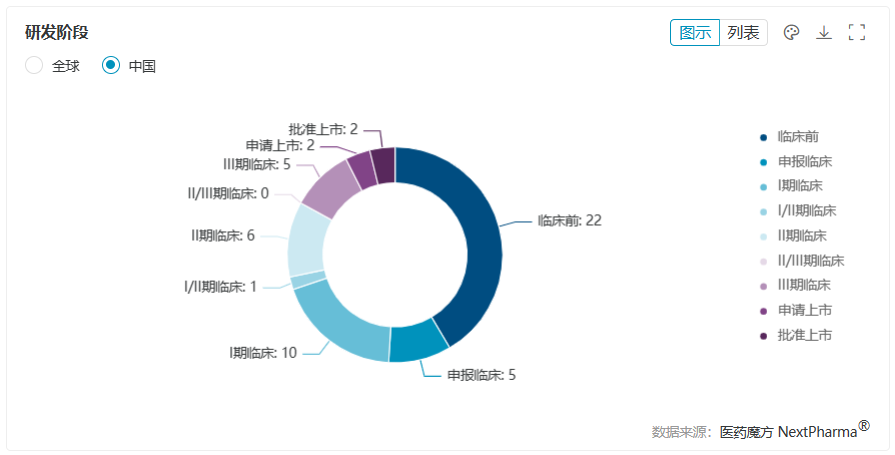
減肥藥的熱潮從西方吹到東方,國內藥企自然不願缺席這個有望誕生暢銷大單品的新領域,同時也拉動上下遊產業鏈的急速擴張。此前,“減肥藥概念股”更是在A股市場逆勢大漲,一度成為資本市場的“寵兒”。拋開市場情緒,不難發現國內佈局減肥藥的玩傢雖多,但多數未披露實質的臨床數據。
根據醫藥魔方數據庫,國內玩傢針對肥胖適應癥共佈局53款GLP-1新藥,約有70%的候選新藥尚處於臨床前至I期臨床階段。結合管線進度和密度來看,信達、恒瑞和華東醫藥排位靠前。
信達與勃林格殷格翰眼光相似,把寶壓在每周1次的GLP-1R/GCGR雙重激動劑IBI362上,主要開發6mg和9mg兩種劑量,以覆蓋不同程度的肥胖患者。考慮到用藥便捷性,信達簡化IBI362的劑量遞增方案,僅需2步劑量滴定即可達到維持劑量,而多數療法則需要5-6步左右。
給藥24周,6mg的IBI362使超重或肥胖患者體重減輕9.85kg,降幅為11.57%。有1例患者因不良反應提前終止治療,經研究者判定與藥物無關。
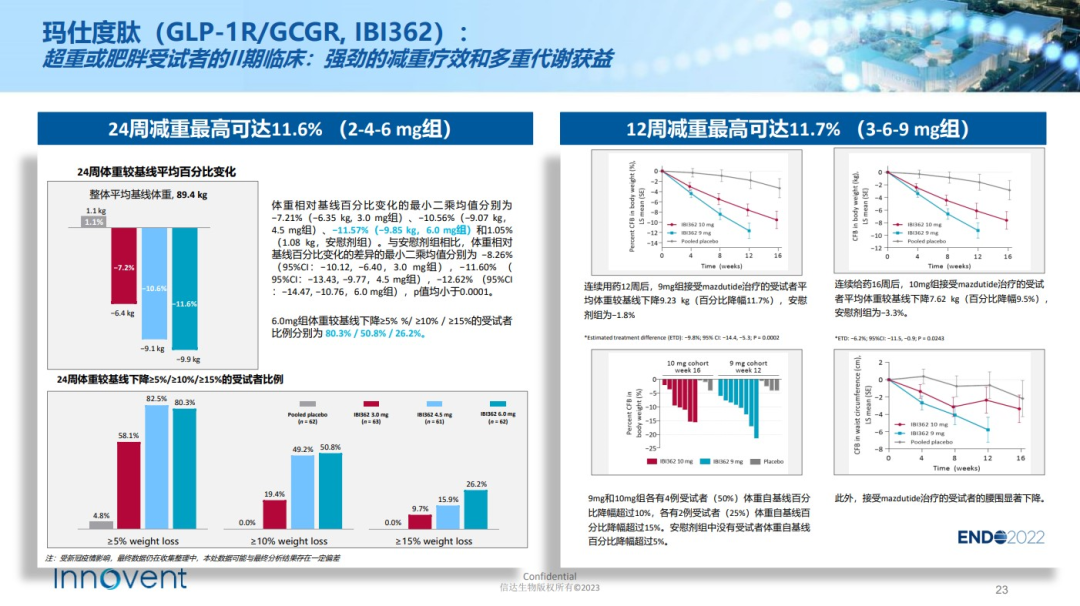
高劑量的IBI362減肥攻勢更猛,瞄準中重度肥胖患者。9mg給藥12周的減重效果即達到與6mg給藥24周的水平,患者平均體重下降9.23kg,降幅為11.7%。
之後,信達在BMI指數更大的群體中開展24周的療效探索。經安慰劑組校正後,9mg組體重下降14.7kg,降幅為15.4%。在達成24周主要終點後,信達乘勝追擊,將研究治療期延長至48周。最新數據顯示,給藥48周,9mg組患者體重較安慰劑組下降17.8kg,降幅為18.6%。
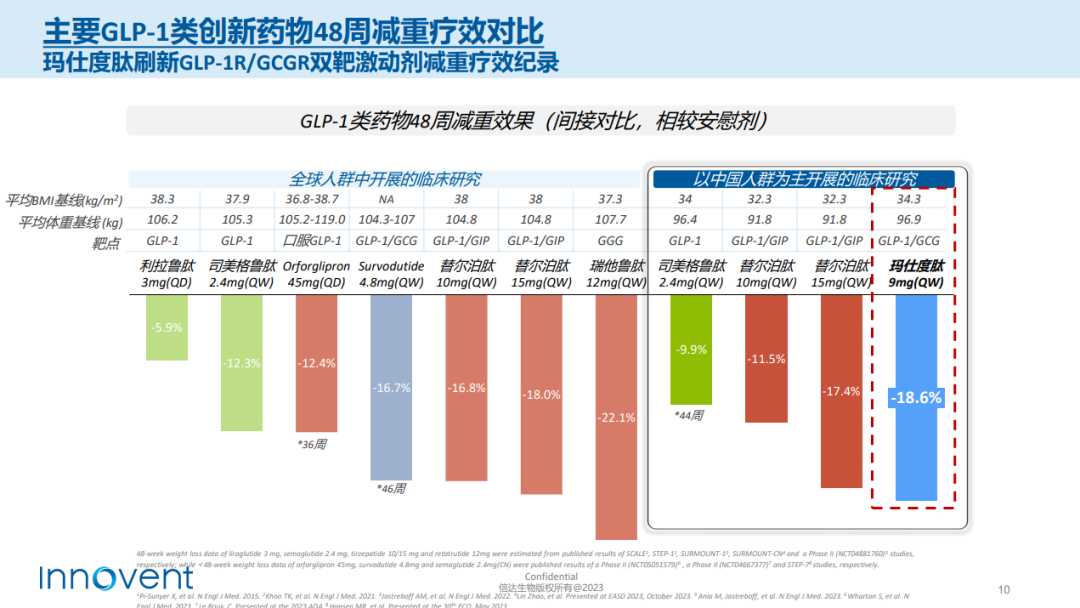
安全性表現良好。不管是24周還是48周的9mg治療期間,沒有患者因不良事件終止治療。
從開發速度上看,信達在國內競賽者中位次領先,目前已開啟代號為GLORY-1的III期減肥研究,該研究將IBI362的治療時間延長至48周,計劃招募600例受試者。另一項高劑量IBI362的III期減肥臨床也被信達納入2023年的日程之中。
不同於信達集中資源全力推進IBI362的精耕策略,恒瑞在減肥領域的佈局追求更多可能性,從管線數量上占據一定優勢。每日一次的GLP-1R激動劑諾利糖肽對標利拉魯肽,正在開展治療肥胖的III期研究,有可能成為恒瑞進軍減肥市場的敲門磚。
依從性更好的GLP-1R/GIPR激動劑HRS9531在2023年5月獲批減肥臨床。一項用於健康受試者的I期臨床(NCT05152277)顯示,接受4周治療的5.4mg組平均減重范圍為4.3-7.7kg,幅度達6.7%-9.3%。小分子GLP-1R激動劑HRS-7535在I期(NCT05347758)研究中初顯減重效果,接受每日1次口服120mg HRS-7535治療的受試者第29天時的體重下降4.38kg。
向減肥領域發起全面進攻的還有華東醫藥。2023年7月,其利拉魯肽生物類似藥斬獲肥胖或超重適應癥,在國內GLP-1類減肥市場上率先卡住身位。此外,華東醫藥也留有後招,在研管線中排列著司美格魯肽生物類似藥、GLP-1R/GCGR/FGF21R長效三靶點激動劑DR10624、GLP-1R/GIPR雙靶點激動劑HDM1003和DR10627、小分子GLP-1R激動劑HDM1002等。
總結
黃金賽道、重磅炸彈、千億空間……減肥市場已被貼上各種各樣的標簽。制藥企業們“擠破頭”搶灘減肥賽道,從GLP-1R單靶到GLP-1R/GCGR雙靶、GLP-1R/GIPR雙靶,再到GLP-1R/GIPR/GCGR三靶、GLP-1R/GCGR/FGF21R三靶,研發技術不斷迭代升級的背後也使後來者入局門檻日益抬高。打法有以少勝多,但沒有以弱勝強,從來都是以己之長克人之短。未來能夠避免被淘汰命運的減肥藥物,註定隻是那些Me better乃至BIC。