3月24日,港股上市公司騰盛博藥(股票代碼:2137.HK)發佈2022年度全年財務業績及公司最新進展。其中提到,騰盛博藥已決定結束新冠中和抗體安巴韋單抗和羅米司韋單抗聯合療法項目,並已停止其生產工作以將資源重新轉向核心項目。
騰盛博藥網站截圖
公開資料顯示,騰盛博藥成立於2018年,目前在位於羅利-達勒姆、舊金山灣區、北京和上海等生物技術中心開展業務。2021年7月13日,公司在香港聯合交易所正式掛牌上市,股票代碼為2137.HK。
安巴韋單抗和羅米司韋單抗是新冠病毒中和抗體聯合治療藥物,由騰盛博藥與清華大學和深圳市第三人民醫院共同成立的子公司騰盛華創醫藥技術(北京)有限公司所共同研發,屬於從 COVID-19 康復期患者中獲得的非競爭性新型嚴重急性呼吸系統綜合癥病毒 2(SARS-CoV-2)的單克隆中和抗體。
2021年12月長效安巴韋單抗和羅米司韋單抗聯合療法獲中國國傢藥監局批準,通過以靜脈輸註,兩種藥物順序給藥的方式,用於治療輕型和普通型且伴有進展為重型(包括住院或死亡)高風險因素的成人和青少年(12-17歲,體重 ≥40 kg)新型冠狀病毒感染(COVID-19)患者。其中青少年(12-17歲,體重≥40kg)適應癥人群為附條件批準。
由於在生產質量管理規范(GMP)認證上花費較長時間,直到8個月後,安巴韋單抗和羅米司韋單抗開始商業化。騰盛博藥表示,自安巴韋單抗和羅米司韋單抗聯合療法商業化上市以來,已基本將該藥物的全部適銷產品銷售到全國25個省份的358傢醫院,獲得收入約人民幣5,160萬元。作為其確保人道主義援助和協助控制疫情爆發承諾的一部分,公司在該抗體藥物商業化上市前已向全國多達21個城市的22傢醫院捐贈近3,000人份的抗體用於緊急救治。
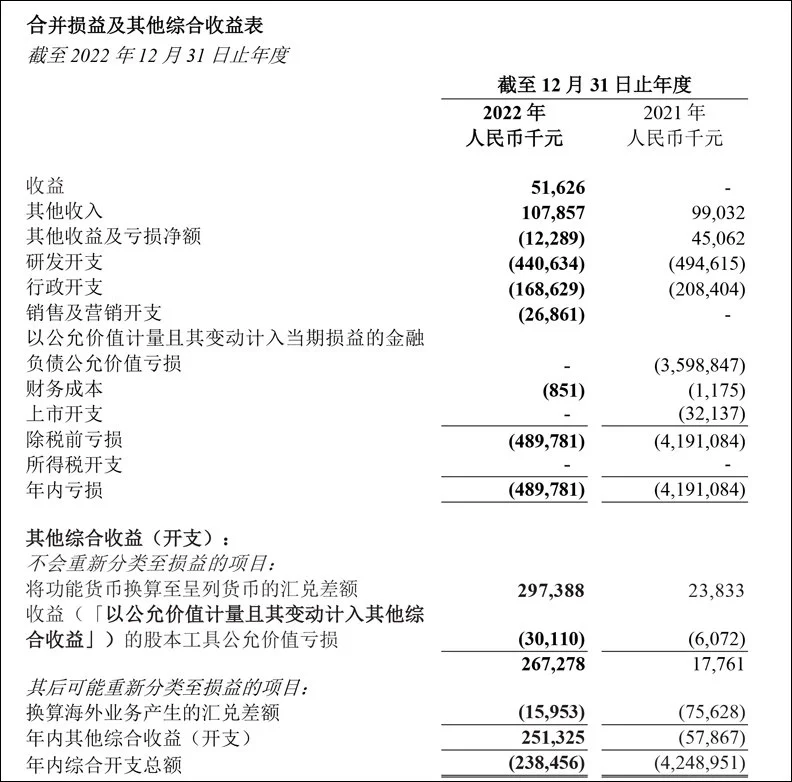
合並損益表顯示,年收入由零增加至人民幣5160萬元的主要原因是安巴韋單抗╱羅米司韋單抗聯合療法在中國的商業化。
公告指出,2023年1月,中國國傢衛生健康委員會在《新型冠狀病毒感染診療方案(試行第十版)》及《新型冠狀病毒感染重癥病例診療方案(試行第四版)》中重申安巴韋單抗和羅米司韋單抗註射聯合療法。多個獨立實驗室的活病毒和嵌合病毒實驗檢測數據表明,長效安巴韋單抗和羅米司韋單抗聯合療法對常見新冠病毒變異株均保持活性,包括B.1.1.7(阿爾法, Alpha)、B.1.351 (貝塔, Beta)、P.1(伽馬, Gamma)、B.1.429 (伊普西龍,Epsilon)、B.1.617.2 (德爾塔, Delta)、AY.4.2 (德爾塔+,Delta Plus)、C.37 (拉姆達, Lambda) 、B.1.621 (繆, Mu)、B.1.1.529(奧密克戎, Omicron),以及BA.1.1、 BA.2、 BA.2.12.1、BA.4/5 、BF.7 (奧密克戎亞型變異株)。
公告提到,做出這一決定的因素包括基於不斷演變的新冠疫情趨勢,和美國衛生和公共服務部(HHS)於2023年5月結束新冠肺炎聯邦公共衛生緊急狀態(PHE)的計劃,以及被拖延的公司受托生產企業(CDMO)的現場監管核查。騰盛博藥公司正在與美國FDA溝通,在完成所有監管要求後,將在適當的時候撤回緊急使用授權(EUA)申請,並會與中國NMPA進一步溝通,在2023年三季度完成監管機構的各項要求後,撤回生物制品許可申請(BLA)。騰盛博藥公司預計未來無論在中國或美國以及其他地區,不會再從該聯合療法中產生可觀收入。
值得註意的是,據北京商報2022年7月報道,原騰盛博藥大中華區總裁兼總經理羅永慶曾表示,在研發安巴韋單抗和羅米司韋單抗的時候,公司前後投入超過2億美元,以確保研發和商業化的順利進行。
3月27日收盤,騰盛博藥股價為5.010港元/股,微跌0.40%。而時間線拉長來看,其相較於此前高點已經跌去約六成。