日前,歐洲藥品管理局人用藥品委員會(CHMP)采納積極意見,建議給予Awiqli(基礎胰島素周制劑依柯[icodec]胰島素)用於治療成人糖尿病的上市許可。諾和諾德(NVO.US)預計在約兩個月內收到歐盟委員會的最終上市許可。除歐盟,諾和諾德在2023年第二季度也完成向美國FDA與中國監管單位的上市申請遞交,目前正在等候審評結果公佈。

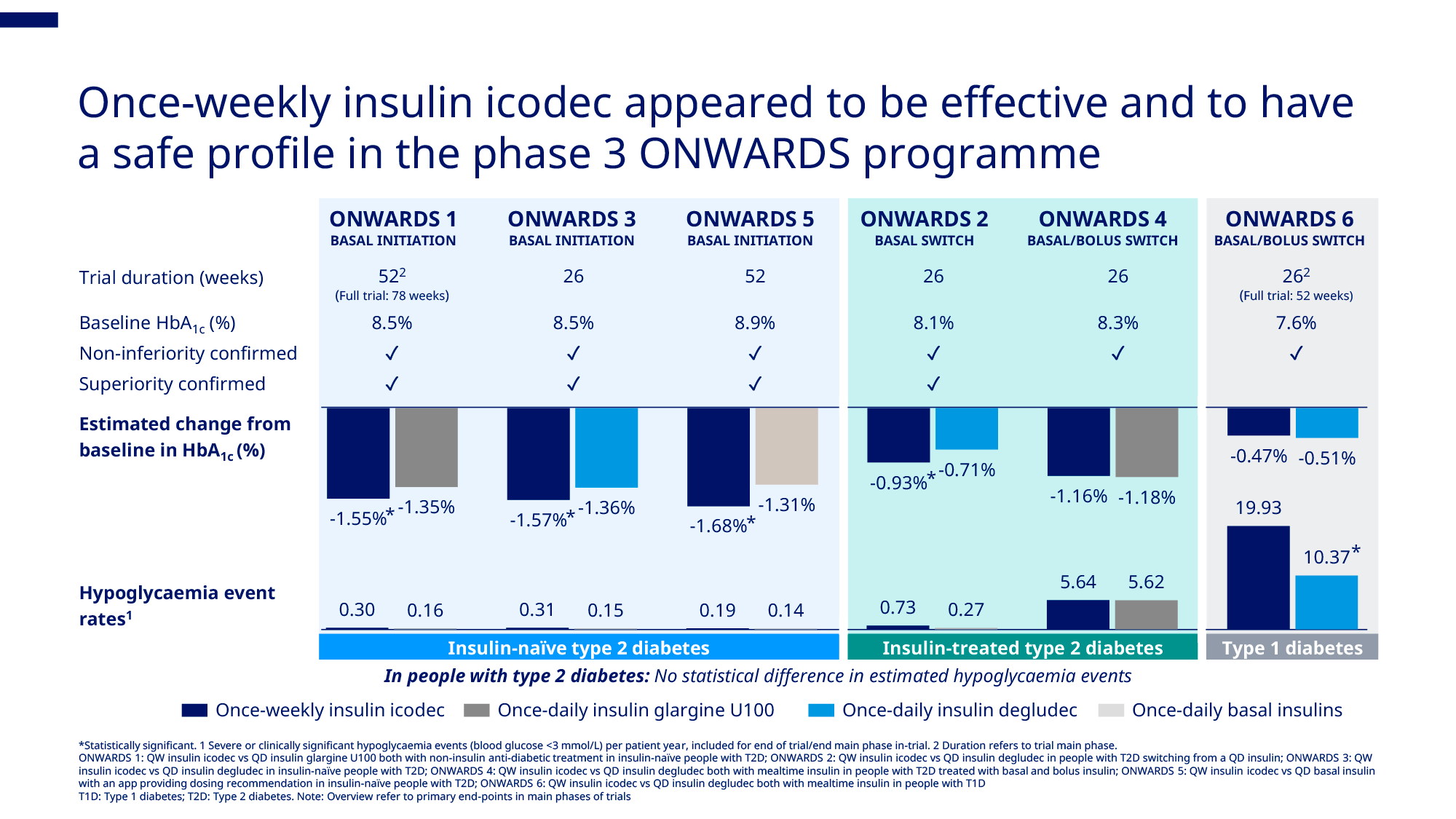
此次CHMP的積極意見基於ONWARDS 3a期臨床試驗項目的結果。相較於每日註射的基礎胰島素,基礎胰島素周制劑依柯胰島素在2型糖尿病患者中達到更優的血糖降幅(以糖化血紅蛋白水平[HbA1c]變化衡量)和更優的血糖“目標范圍內時間”(在建議血糖范圍內的時間)。
根據世界衛生組織(WHO)的統計,全球有超過4億糖尿病患者。針對糖尿病,除開發每周一次使用的長效依柯胰島素外,諾和諾德在基礎胰島素的研發上另有IcoSema處於3期臨床階段。IcoSema是每周一次基礎胰島素icodec和每周一次司美格魯肽(700U/2毫克/毫升)的固定比例組合。
今年1月所公佈的COMBINE 3臨床3a期試驗結果顯示,在679名使用每日一次基礎胰島素控制不佳的2型糖尿病患者中,每周一次的IcoSema與每日註射一次的胰島素療法相比,在降低HbA1c上顯示具非劣效性。此外,諾和諾德旗下亦有多款下一代胰島素,包含Tresiba、Xultophy、Ryzodeg、Fiasp。