4月23日,一架從肯尼亞內羅畢起飛的國際航班KQ880抵達廣東省廣州市白雲國際機場,新的變體隨著航班登陸國土。在所有旅客均被轉移至隔離酒店進行14天常規醫學觀察和常規核酸檢測的前提下,其中一名27歲的中國男性於4月27日報告新冠病毒核酸陽性。值得註意的是,他全程接種新冠病毒疫苗,並且在過去14天內沒有接觸過其他新冠肺炎病例。
確診後,他被轉至廣州醫科大學附屬市八醫院接受治療。
4月30日,該患者的鼻拭子樣本基因測序顯示,他感染的是奧密克戎亞型毒株BA.2.12.1。又一個新的毒株,初步的調查現實,在刺突蛋白的基因上共檢測到33個氨基酸突變位點,其中L452Q和S704L為BA.2.12.1亞譜系的關鍵位點。
這一變體在國內迅速流行開來,傳播速度快、隱匿性強,引發吉林、上海、香港等地出現規模性疫情。而中疾控的周報指出,幾項研究表明,BA.2.12.1亞型的傳播速度比BA.2還要快約23%至27%。
同時,早在3月14日,中國疾控中心流行病學首席專傢吳尊友曾表示,奧密克戎毒株BA.1的傳播速度比德爾塔毒株增加約70%多,而BA.2又比BA.1傳播速度高出60%多。中疾控在5月16日的周報指出,BA.2.12.1亞型的傳播速度比BA.2亞型還要再快約23%至27%。
今天,筆者打開實時監測數據,數據顯示,海外感染人數僅一天新增近114萬例。根據世界衛生組織的公告,這一數字的始作俑者奧是密克戎毒株及其分支,目前已經成為全球主要流行株。
如今,多項微觀世界研究不斷展開,揭開奧秘克戎變體高傳染率之下的神秘面紗。
為什麼傳播這麼快?
新冠病毒是RNA病毒,及主要遺傳物質由RNA組成,其自身結構(單鏈)特性讓它更容易發生突變,相比於DNA病毒,他的穩定性更低。因此從疫情爆發至今,會有不同的變體出現。他們無一例外都有一個特性,即每次突變都會讓病毒本身更具適應性,更適應人體甚至是動物,
如今到病毒過渡到奧密克戎變體這一版本,傳染效率無一例外的上升,他們如有神助,對人體發起總攻。
而一切的根源在微觀世界中可能是某個堿基的改變,也就是上文說的點位,點位的堿基發生突變,基因鏈條更新,經過轉錄和翻譯後,在病毒表面產生新的刺突蛋白,新的蛋白擁有“超能力”,更易感染人群,也就是如今的BA.1、BA2以及更為分之的亞傢族。
我們都知道奧密克戎毒株的特征在於刺突蛋白的受體結合結構域 (RBD) 內(由 1、2 和 3 類 RBD 定向抗體靶向的區域)和N末端結構域 (NTD)超位點內的多重變化。
受體結合域,顧名思義,就是與“受體”結合的區域,類似於鎖於鑰匙關系中的那把鑰匙,人體內容易被感染該病毒的區域,即為受體(ACE2)——那把鎖。
研究表明,在刺突蛋白中,BA.1和BA.2亞譜系共有21個氨基酸突變,其中BA.1中有12個不同的突變,BA.2中有6個突變。其中,G339D(點位名稱)、N440K、S477N、T478K、Q498R和N501Y突變增強刺突蛋白與人ACE2受體的結合能力,而Q498R和N501Y在此基礎上“更上一層樓”,再一次加強結合能力。
如上圖所示,其中彩色被標記部分均為突變點位,導致受體結合域的結合能力變強。從左下角的縮小圖中可以看出,增強的部分在刺突蛋白中占比較多,進一步說明奧密克戎BA.1和BA.2(以及其亞族)突變毒株將會更容易與人體結合,進而大大增強傳染力。(圖源:Nature)
同時,通過對突變位點的深度突變掃描 (DMS),我們可以預測單克隆和多克隆抗體與人體ACE2區域結合深度的變化,結合深度越深,則代表疫苗及免疫系統將會更大限度的保護人類,反之則將大大失效。
科學傢通過對奧密克戎中14個突變展開計算,得出免疫逃逸分數,逃逸分數代表與抗體的結合能力,分數越高,能力越低。其中,七種在受體結合域中存在的突變(K417N、G446S(BA.1)、E484A、Q493R、G496S(BA.1)、Q498R和N501Y與抗體結合減少呈正相關。
中疾控的周報指出,與其他奧密克戎亞型相比,BA.2.12.1亞型在接種疫苗加強針後,仍具有更強的免疫逃逸能力。同樣值得關切的是在南非發現的奧密克戎亞型變異株BA.4與BA.5。這兩個亞型同樣存在L452突變,與德爾塔在這一位置的突變一模一樣,因此都表現出顯著的免疫逃逸能力。
患者血清中的中和抗體(NAb)水平是衡量疫苗有效性的關鍵指標,並與免受感染保護密切相關。抗體滴度是用來衡量某種抗體可以識別特定抗原表位所需要的最低濃度。
如何理解這一概念和數值大小對疫苗作用結果的闡釋,打個比方,通過間接庫姆伯斯試驗(indirect Coombs test)檢測一個孕婦血清中抗體,一個患者可能報告通過此試驗檢出的抗體滴度為16,這表示隻要血清的稀釋度不超過1/16(1份比例的血清和15份比例的稀釋液),此試驗都能得到陽性結果,即可識別出抗原 。如果稀釋度超過1/16,則檢出的結果皆為陰性,即抗體無法識別抗原。還有可能發生的情況是,幾周過後,同樣一位患者可能檢測出抗體滴度達到32(1份比例的血清和31份比例的稀釋液),這可能是因為孕婦體內產生更多的抗體,以至於即使更高的稀釋度也能得到陽性結果。簡單來說,中和抗體滴度上升越快,則代表疫苗效率越好。
回到本次實驗,科學傢們收集接種第二劑BNT162b2(mRNA疫苗)、ChAdOx1(重組蛋白疫苗) 和mRNA-1273(mRNA疫苗)後14天以上的健康志願者血清中的中和抗體濃度,並將志願者分為三個年齡匹配組(n =每組24人,平均年齡45歲)。
結果顯示,與ChAdOx1(重組蛋白)疫苗接種者相比,接種BNT162b2或mRNA-1273(mRNA疫苗)的個體血清內抗體反應能力更高。但相對而言,針對奧密克戎BA.1毒株,三種疫苗的效率顯著降低,其中BNT162b2降低33倍,ChAdOx1降低14倍,mRNA-1273 降低74倍。
為測試第三針加強針對奧密克戎突變毒株是否有作用,科學傢又展開相關實驗。
在接種第三劑加強針後至少14天對疫苗接受者的樣本進行分析,施用第三劑疫苗促進病毒變體的中和,對奧密克戎BA.1 和 BA.2的中和反應在兩次接種後顯著降低,在三次接種後部分恢復。對於mRNA疫苗而言,接種第三劑將大大降低感染的可能性,但無法完全恢復免疫力。
但是,面對較高的免疫逃逸數據,研究人員也認為,如果疾病傳播再次出現不可控的高潮,可能需要研發相關的特異性疫苗,專門針對這一突變毒株。但相對樂觀的是,在感染的年輕人早期跡象表明,奧密克戎感染比德爾塔輕40-70%。目前,針對40歲以上感染人群,並未得到準確測算數據。
感染方式發生轉變
根據以往我們對新冠病毒的認知,它常常會在感染者的肺部大量復制,並影響肺部功能。但針對奧密克戎BA.1而言,這一情況似乎發生改變,
研究人員在人肺上皮細胞系Calu-3中比較奧密克戎BA.1和德爾塔毒株的復制情況,其中,德爾塔毒株在72小時內表現出相當強大的復制動力學水平,在感染後48-72小時之間具有可見的細胞病變效應(CPE)。
相比之下,奧密克戎BA.1的滴度在每個時間點至少低一個數量級,這些觀察結果與最近得出的結論——其在下呼吸道組織中的復制能力和毒性降低一致。
同時,之前我們曾解到,新冠病毒主要通過有效利用TMPRSS2(發音為tempress two,一種蛋白酶通道)進入細胞,讓病毒膜和細胞膜融合在一起。
通過這一原理,以往我們可以通過利用胰蛋白酶處理細胞,水解這一蛋白酶通道,降低新冠病毒表面的刺突蛋白與受體結合域之間的適配性,從而大大降低新冠毒株的感染能力。但奧密克戎毒株似乎顛覆這一慣性認知。
奧密克戎毒株開始明顯偏好在上氣道組織(鼻、咽與喉)中復制,BA.1毒株在人鼻上皮細胞(hNEC)中德爾塔毒株更具有復制優勢,這與Calu-3細胞的感染形成對比,Calu-3細胞是下呼吸道衍生的細胞系。hNEC和Calu-3細胞的免疫印跡顯示相反的蛋白酶表達模式——Calu-3細胞具有高水平的TMPRSS2表達,而Cathepsin-L(進入內體所需)在hNEC中占主導地位。
這種相關性表明進入通路轉換可能決定組織偏好。當比較受感染的hNEC和Calu-3細胞中的刺突蛋白作用時,觀察到毒株BA.1刺突的切割減少,融合性更高。
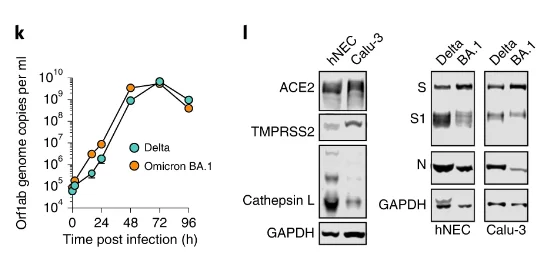
從上圖中可知,通過胰蛋白酶水解TMPRSS2通道後,奧密克戎的結合能力仍出現上升(圖K中橙色圓點的縱坐標數值更高),證明如今奧密克戎毒株已經不再用過去的方式進入人體,開始對進入路徑進行突變優化,更加適應並進一步提高傳播能力(圖源:Nature)
這些實驗表明奧密克戎BA.1和BA.2刺突蛋白生物學上發生根本性變化,它形成合胞體的能力降低,被優化為通過內體優先進入,從而導致細胞向性的改變,這種生物學上的轉變也可以證明為什麼奧密克戎毒株的傳播和發病機制發生明顯變化。
總結來說,先前已顯示新變體的基因型變化,是通過調節先天免疫反應以及逃避適應性免疫反應來改變病毒表型。此外,突變可以改刺突峰蛋白的功能以影響傳播和發病機制,這種變化可能為新型病毒提供在肺細胞和原代人氣道上皮細胞中的選擇性優勢。
可見,奧密克戎變體已將進入途徑偏好轉換為不依賴TMPRSS2的內體融合——這是病毒生物學行為的重大變化,可能會改變組織嗜性。這種進入途徑的轉換伴隨著蛋白水解過程的改變和感染細胞中合胞體形成的減少,可能是為限制細胞間的傳播和發病機制。
總之,重要的是要註意,即使是毒性較小但傳播率非常高的奧密克戎變體對老年人和有合並癥的人群構成風險,尤其是那些免疫抑制或未接種疫苗的人。
能傳染更多動物,並能從動物再次傳染回人類
還有研究對奧密克戎變體的傳播物種范圍進行研究,中科院微生物研究所高福院士團隊在Cell Discovery發表論文。
評估奧密克戎BA.1與包括人類在內的27個物種的受體的結合情況,發現這一病毒已經能夠將其受體結合譜擴展到果子貍、嚙齒動物、多種蝙蝠以及一些刺蝟中。
通過對BA.1 的突刺蛋白與小鼠受體結合域復合物的冷凍電鏡結構以及與果子貍ACE2(cvACE2)復合物的晶體結構,從而確定影響 Omicron BA.1 宿主范圍的幾個關鍵氨基酸殘基。
結果表明,這些突變產生新的特征,而位於ACE2結合界面上的突變結合起來發揮補償作用,導致奧密克戎的親和力更強。此外,刺突蛋白的結構中,已經發現一些突變(例如,N746K、T547K 和 N856K)會使其構象更加穩定。
盡管BA.1的起源仍然是個謎,但科學傢提出三個假設。
一種可能性是奧密克戎病毒或其祖先變體已經在人類中存在數年,但爆發前並未被發現;一種假設假設是奧密克戎毒株在免疫功能低下感染者體內發生進化;第三,奧密克戎毒株源於動物。
據報道,奧密克戎的祖細胞的突變分子譜與在人類患者中進化的其他新冠病毒變體譜之間存在著明顯不同,但與小鼠細胞環境的進化卻十分相似。他們推測,奧密克戎的祖病毒從人類傳播給小鼠,迅速變異以適應宿主,然後又跳回人類。
先前已有報道證明這一結論,新冠病毒的變體之一B.1.351在野生型小鼠中的直接接觸傳播會導致顯著的病理變化。近日,來自中國香港一傢寵物店的11隻倉鼠被報道感染德爾塔變種,病毒從人類到小鼠的傳播推動病毒的進化和對宿主的適應。
為評估德爾塔和奧密克戎BA.1變體的宿主范圍是否改變,研究人員使用流式細胞術和表面等離子共振 (SPR) 測定評估它們的受體結合特征。數據結果表明,小鼠可能是奧密克戎毒株的原始宿主。
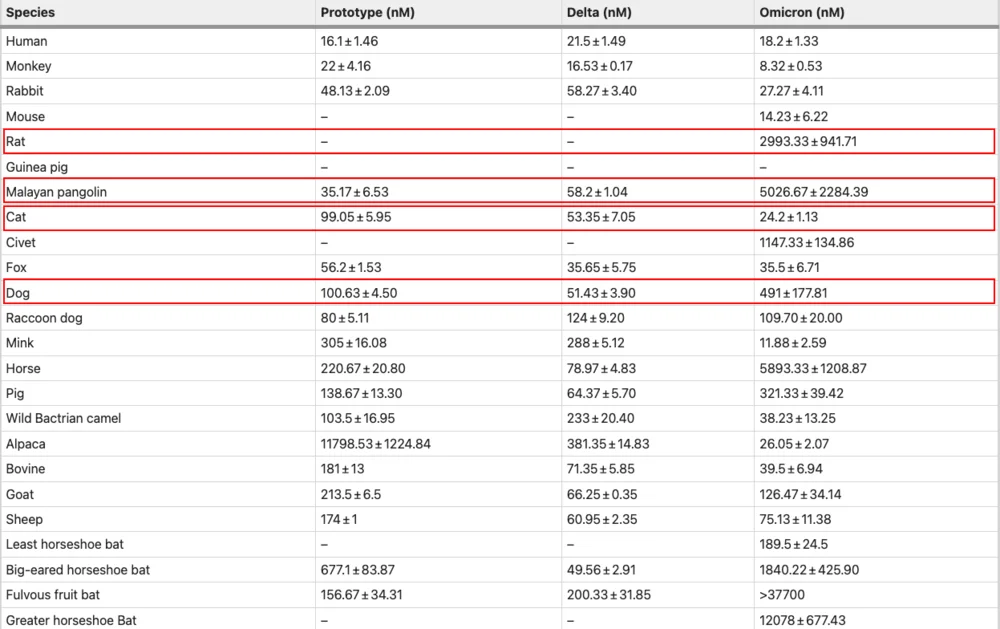
上表為不同動物對德爾塔毒株和奧密克戎毒株的親和力對比,其中可以看出小鼠的親和力發生巨大的變化,同時狗的親和力也出現上升,這給傢養狗、倉鼠等寵物的讀者們提一個醒,你們之間可能會存在交叉傳播(圖源:Cell Discovery)
目前,科學傢已在幾種動物中檢測到新冠感染情況,其中大多數是傢養或動物園動物。雖然這些動物相對容易檢測和監測,但野生動物感染對控制感染提出更大的挑戰。例如,據報道,北美野生白尾鹿的感染率高達70%。因此,持續調查潛在動物宿主中的奧密克戎變體感染情況,對防止跨物種傳播至關重要。
通過冷凍電鏡圖像可知,盡管受體結合在感染中起關鍵作用,但刺突蛋白中的其他殘基也可能影響病毒進入。例如,點位D614G克穩定增強刺突蛋白的穩定性。因此,BA.1的刺突蛋白中其他突變也可能影響起感染能力。
寫在最後
在沒有相關的研究論文出現之前,筆者對有關奧密克戎的傳播始終持謹慎報道的想法,但在閱讀多篇文獻後,發現病毒中發生突變的小小一個基因點位,仿佛首個倒下的多米諾骨牌,在人類甚至在動物群體中產生蝴蝶效應。
每一次研究的深入,在讓我們更加解病毒的同時,也清楚在微觀世界中,突變總會發生已經成為RNA病毒世界的“真理”,面對它,我們隻能在科學試驗中不斷實踐,從解到適應,再到最後的徹底克服,道阻且長。
科學從不說謊,但面對微觀世界的“真理”,時刻保持警惕是人類世界的武器。